結合の仕組み 陽イオンと陰イオンはプラスとマイナスなので、お互いに引き合います。 この静電気的な引力を クーロン力 といい、このクーロン力で結びついた結合が イオン結合です。 陽イオン 単原子イオン 金属元素 (Na + ,Ca 2+ など) 多原子イオン NH4のみ 陰イオン共有結合との違いと組成式・分子式を図で徹底解説 完全版受験で必須の単原子イオン・多原子イオンの一覧とラクな覚え方 views 4 図解電子配置の書き方の解説と電子配置の一覧(周期表) views 5(組成式) (分子式) ・金属元素 ⇒ 金属結合 ⇒ 金属結晶 (組成式) 注:共有結合結晶は数が少ないので、覚える (ダイヤモンド、黒鉛、ケイ素、二酸化ケイ素、炭化ケイ素) 〇結合の強さ 共有結合>イオン結合(金属結合)>分子間力 〇分子間力
Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Comparison Formular
組成式 イオン 結合 一覧
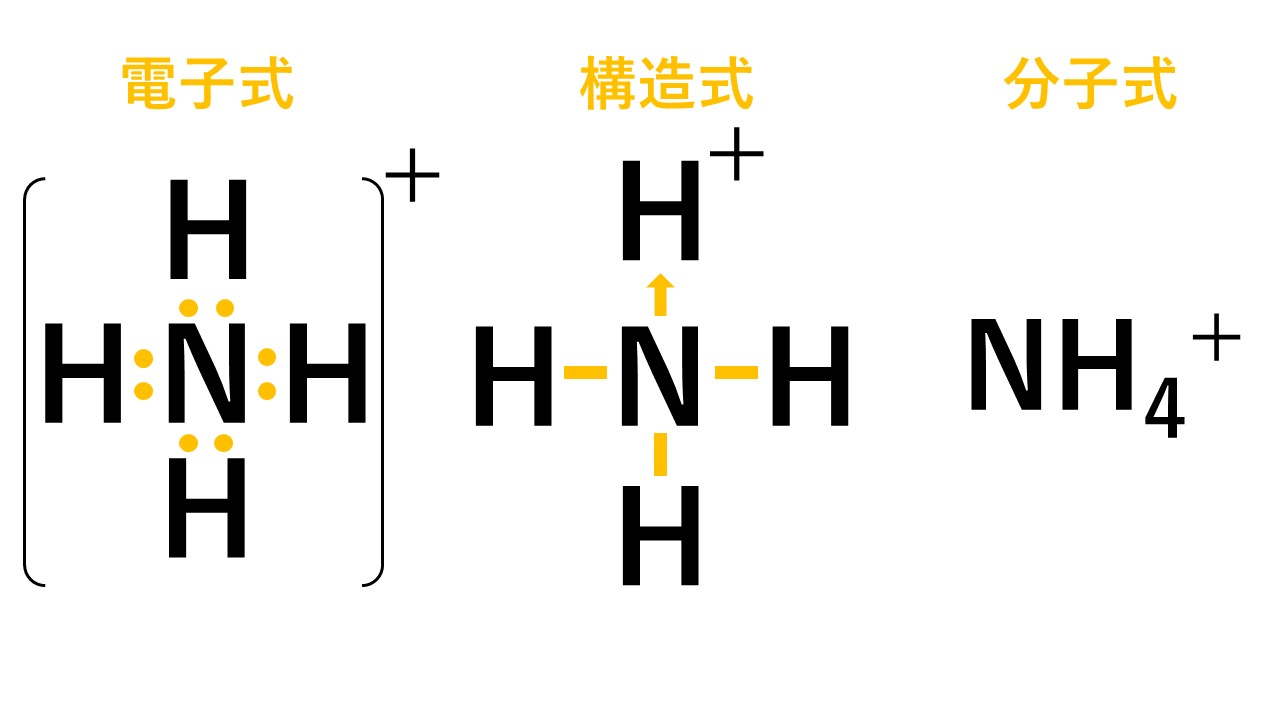
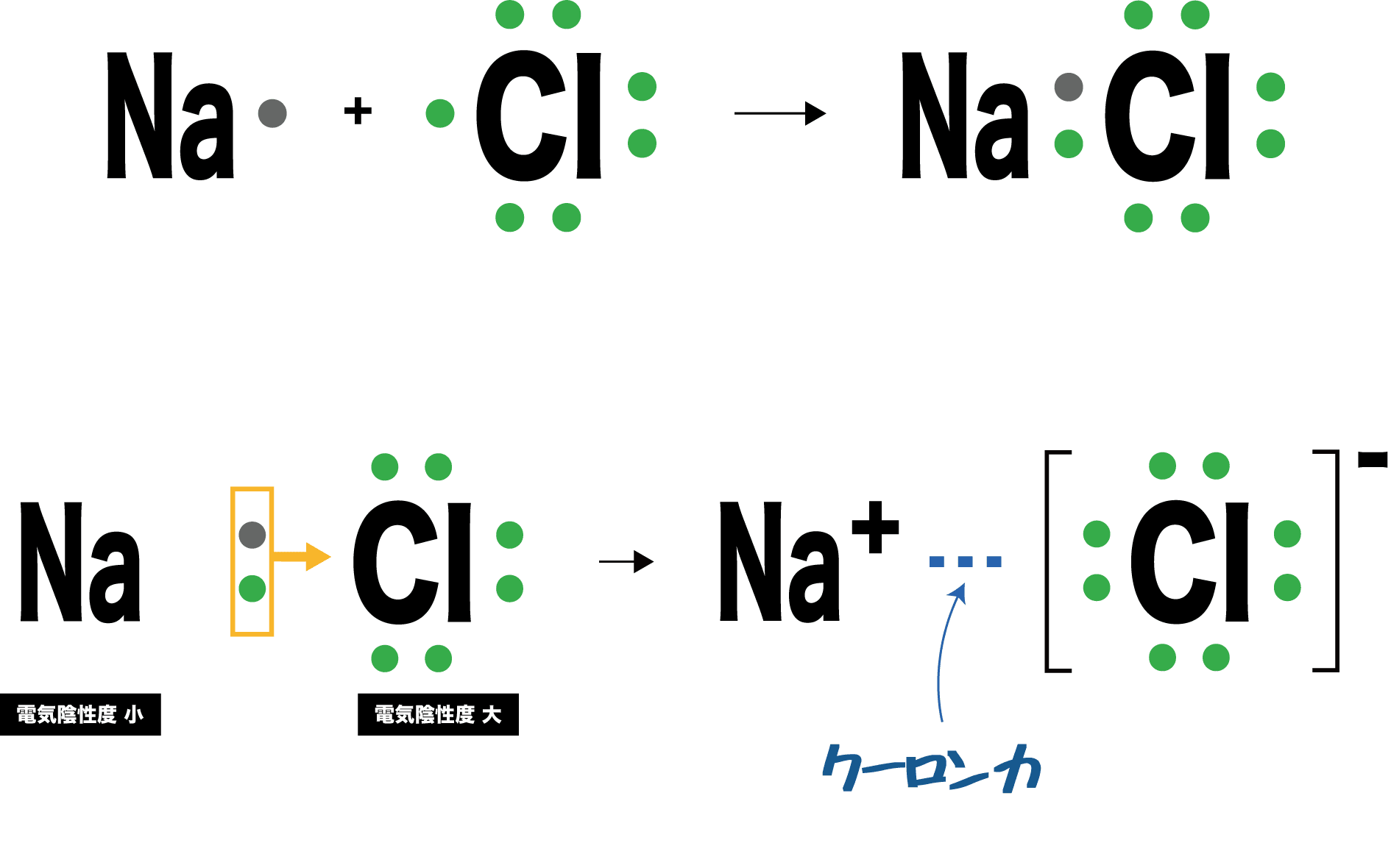
組成式 イオン 結合 一覧-化学式と構造式 化学結合と分子 イオン結合 陽イオン、陰イオンが互いに静電引力(クーロン力)によって 引き合ってできる結合をイオン結合という。金属元素と非金 属元素が結合する場合は、イオン結合となる。 Na →Na eCl e→ClNa Cl→NaCl(4)NH 4 とCl - がイオン結合することで形成されたイオン結晶です。 ただし、NH 4 には、共有結合と配位結合が含まれています。 (5)Na とOH - からできたイオン結晶ですが、OH - には共有結合により構成されています。



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Chem5 Pdf
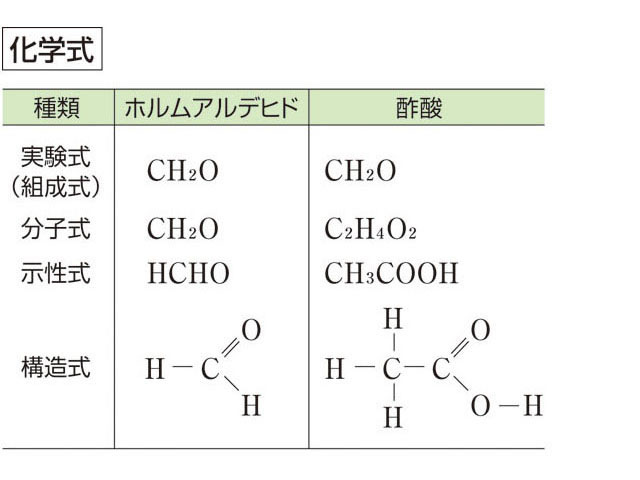
イオン結合によりできている物質をイオン結合性物質といい,化学式で表すときには 組成式を用いる 共有結合 2 つの原子が不対電子を出し合い,共有電子対をつくり,共有することで生じる結合。※1 組成式がch 2 o である分子には、分子式がch 2 oである化合物(例:ホルムアルデヒド)もある。 c 2 h 4 o 2の他、c 3 h 6 o 3もある。組成式がch 2 oである場合、分子式はc n h 2n o n である。 ※2 示性式や短縮構造式として示されているものを、単に分子式と呼ぶイオン結合の組成式についての解説です。 About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy &
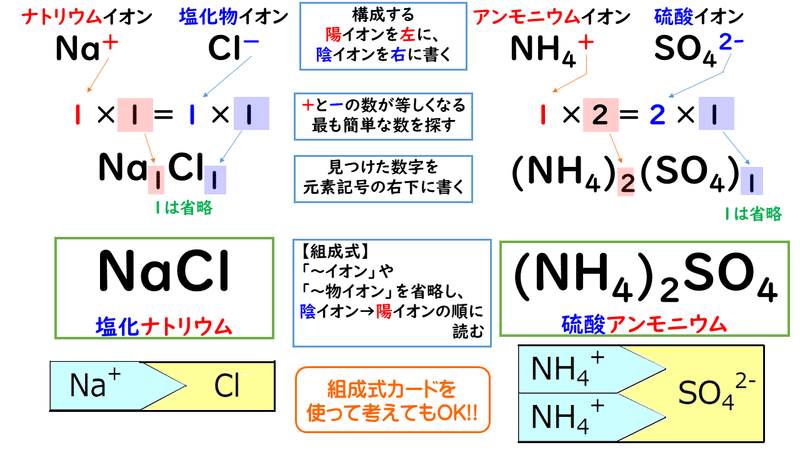
まずは、2つのイオンを陽イオン→陰イオンの順に並べます。 陽イオンはNa ,陰イオンはCl ですね。 Na 、Cl と書いておきます。イオン式 名称 貴ガス 2 イオン結合とイオン結晶 A イオン結合 (化p8/化基p56) ・陽イオンと陰イオンの結合 = ① ( ② によって引き合っている)Safety How works Test new features ©
Ca 2 ,Cl となりますね。 次に考えるのは、イオンの数の比です。 カルシウムイオン1つに対して、塩化物イオンが2つ結合しますから、個数比は 12 ですね。 最後に、この比を右下に書くと、 CaCl 2 となります。 名前は 塩化カルシウム ですね。 (2)NH 4 ,SO 42 アンモニウムイオンが1、硫酸イオンは2の電荷を持ちますから、個数比は 21 ですね。 これをそのまま1.イオン結合はどのようにしてできるか? 2.イオン結晶はどのようにしてできるか? 3.イオン結晶の特徴にはどのようなものがあるか? 4.与えられた陽イオンと陰イオンのイオン式から、組成式を組み立ててつくることができるか?化学基礎の基本練習 P0127 Page 10 1032 9 イオン結合 学習日 月 日 まとめ ① イオン結合 陽イオンと陰イオンが,㋐ 的な引力により引き合って結びつく化学結 合。一般に,金属元素と非金属元素からできた化合物は,イオン結合で粒子が結合している。




組成式をスラスラ書けるようにしよう 化学がちょっとだけ好きな社労士
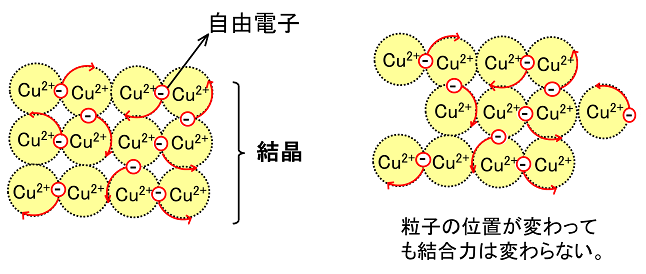



金属結合と金属
そこで分子式、示性式では情報が足りないという場合、 結合状態や立体的な構造も表現したい場合は「構造式」を使います。 H 2FeO 4:鉄酸• 化学組成式は、4つの分野のうちの有機化学と高分子化学において大いにその知識が必要とされます。組成式とは?分子式との違いも解説!一覧表つき!|高校生向け受験応援メディア「受験のミカタ」 😎 ここで勘違いしてほしくないのは イオン式や組成式、分子式は単なる表し方にすぎないということ。分子式とは 1つの分子を構成する元素とその数をただ単に羅列したものであらわされます。 酢酸:C₂H₄O₂やグルコース:C₆H₁₂O₆など。 最も、酢酸やグルコース他は組成式でも分子式でも構造式でもなんだってあらわされます。 ここで勘違いしてほしくないのは イオン式や組成式、分子式は単なる表し方にすぎない ということ。 この分野で苦手意識を持って




イオン結合とイオンからなる物質



Qanda Storage S3 Amazonaws Com ac5 A0f7 4f
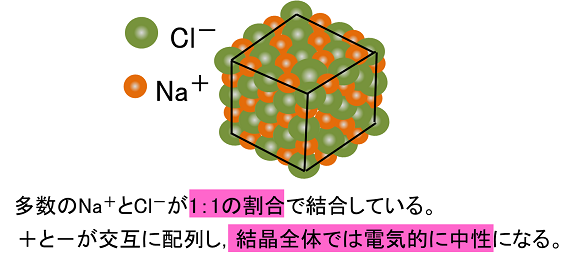
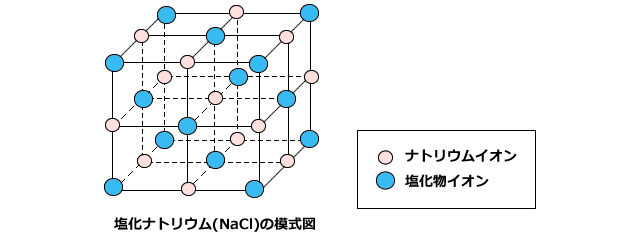
組成式とは? これは、NaClのイオン結晶である岩塩です。 これは、NaとClがずっとイオン結合を連ねて、このような目に見える形になっているのです。 このように、無限にイオン結合が続いているわけですよ。 じゃあ、 分子式 みたいにその塊の原子の数を全部書き出したとします。 すると、この岩塩には、Na とCl – が日本の人口以上に詰まっているわけですよ組成式 順番 分子式とは? 書き方や読み方のルールを総まとめ 化学受験 なので、分子式は分子以外では使えません。 一方組成式は全ての物質で表すことができます。 イオン結合で繋がる塩化ナトリウムNaClは、完全に組成式です。 Na Cl Na Cl Na Cl組成式の問題で、塩化ナトリウムなどの無機物を扱うときには、化学式を与えられず、組成式を物質の名称から答えなければならない場合もあります。 よく用いられる陽イオンと陰イオンの一覧表を作って覚え、組み合わせ方を理解しておけば簡単に問題を解けるようになるでしょう。 よく登場するイオンとしては、次のようなものがあります。 陽イオンLi、Na



3 1 イオン結合とイオン結晶 おのれー Note




なぜ結合しないんですか 大至急お願いします Clear
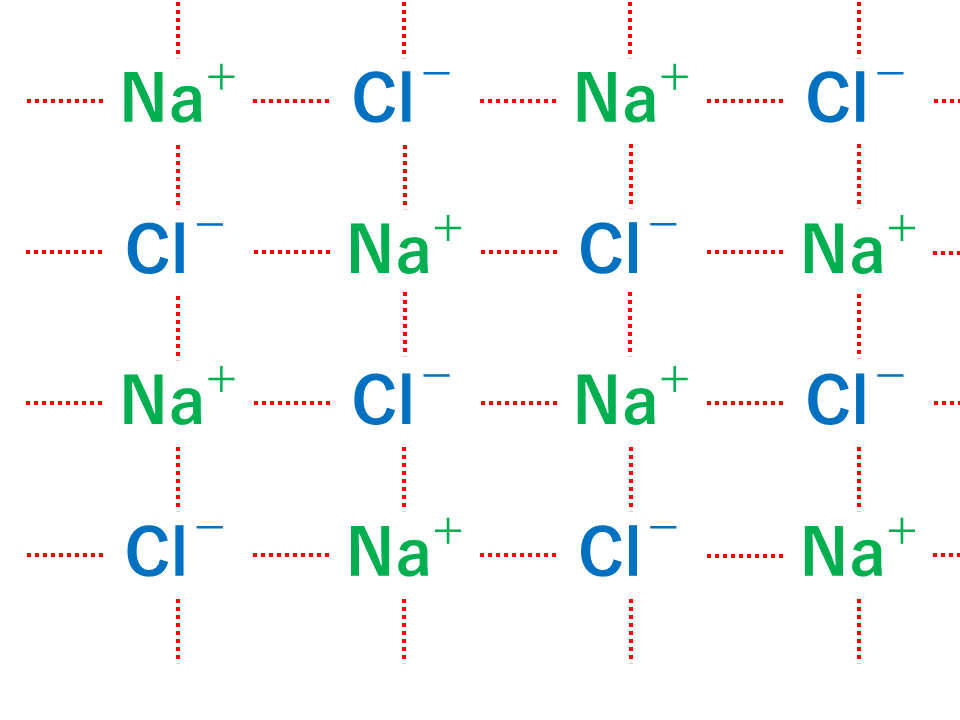
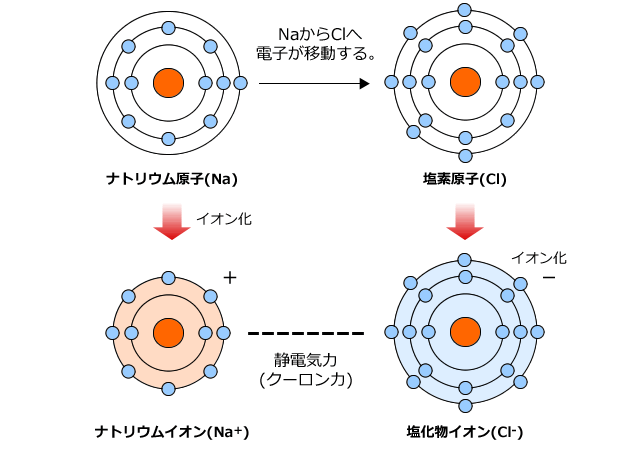
・イオン結合はちょうど電荷がつりあうようになります。 なので na₂h₂co₃だと ↓ 2na⁺, 2h⁺, co₃²⁻ ↓ 1が全部で4個, 2が1個となって 全体で2の電荷を帯びてることになってしまいます。 2の炭酸イオンとちょうどつりあうのは 1のナトリウムイオンと1の水素イオンが、それぞ陽イオンと陰イオンが、静電気的な力で引き合う結合。 イオン結晶 陽イオンと陰イオンが、規則正しく並んでいる結晶。 ※イオン結晶の特徴 ①一般に融点が高い 塩化ナトリウムの融点は約800℃ ②硬いがもろい 規則的に配列しているため硬いが、力が加わり配列がずれると「」と「」に反発が起きて特定の面で割れる(へき開) ③個体では電気を通さないがイオン結合 はじめに塩化ナトリウムNaClを頭に思い浮かべてください。 ナトリウムと塩素を反応させたとき、ナトリウム原子は1価の陽イオン「Na」になり、塩素は1価の陰イオン「Cl」となります。 これらのイオンどうしが静電気的な引力(これを クーロン力 と言います。 )によって引き合い、ひっつくことでNaClが誕生するわけです。 ※NaClが誕生とは言っても




高1 化学基礎 1 これだけは覚えておきたいイオン式 組成式 高校生 Clear




イオン結合とイオン結晶
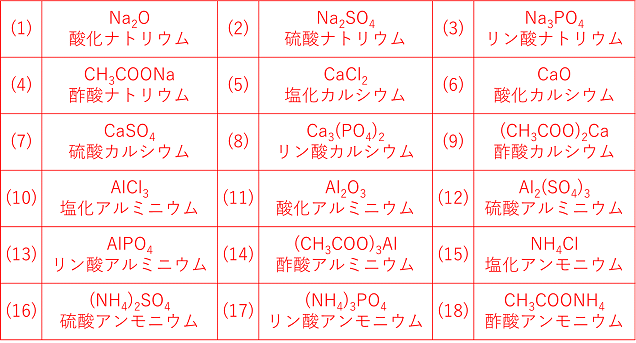
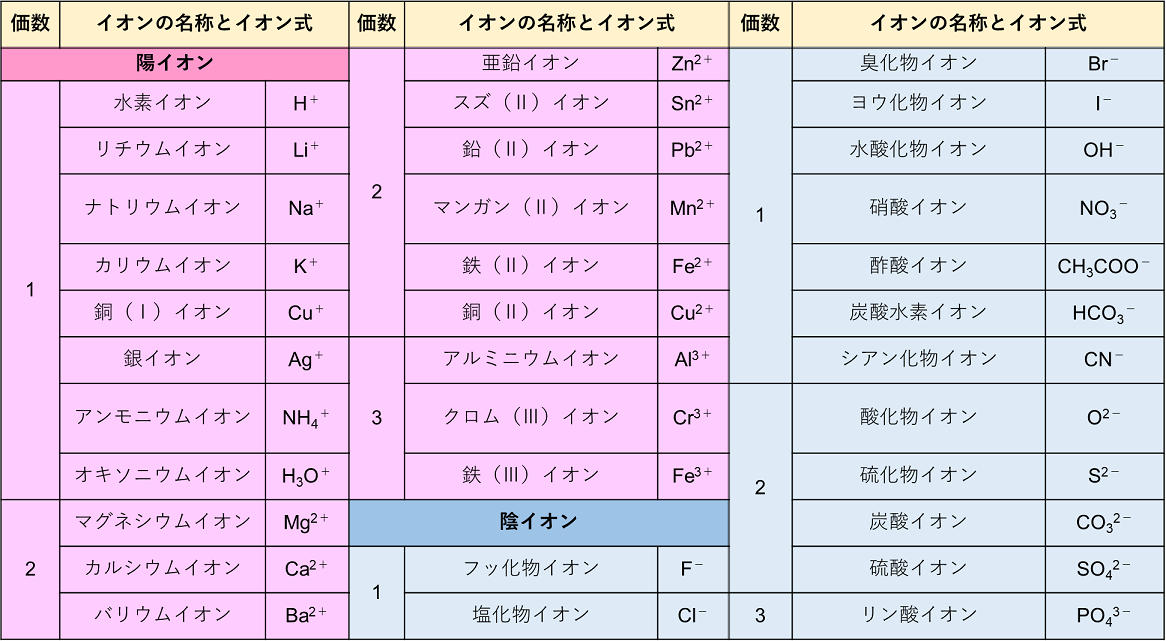
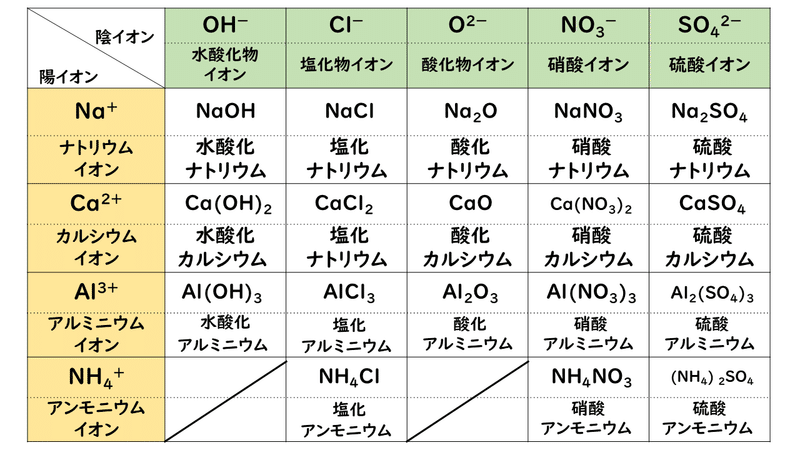
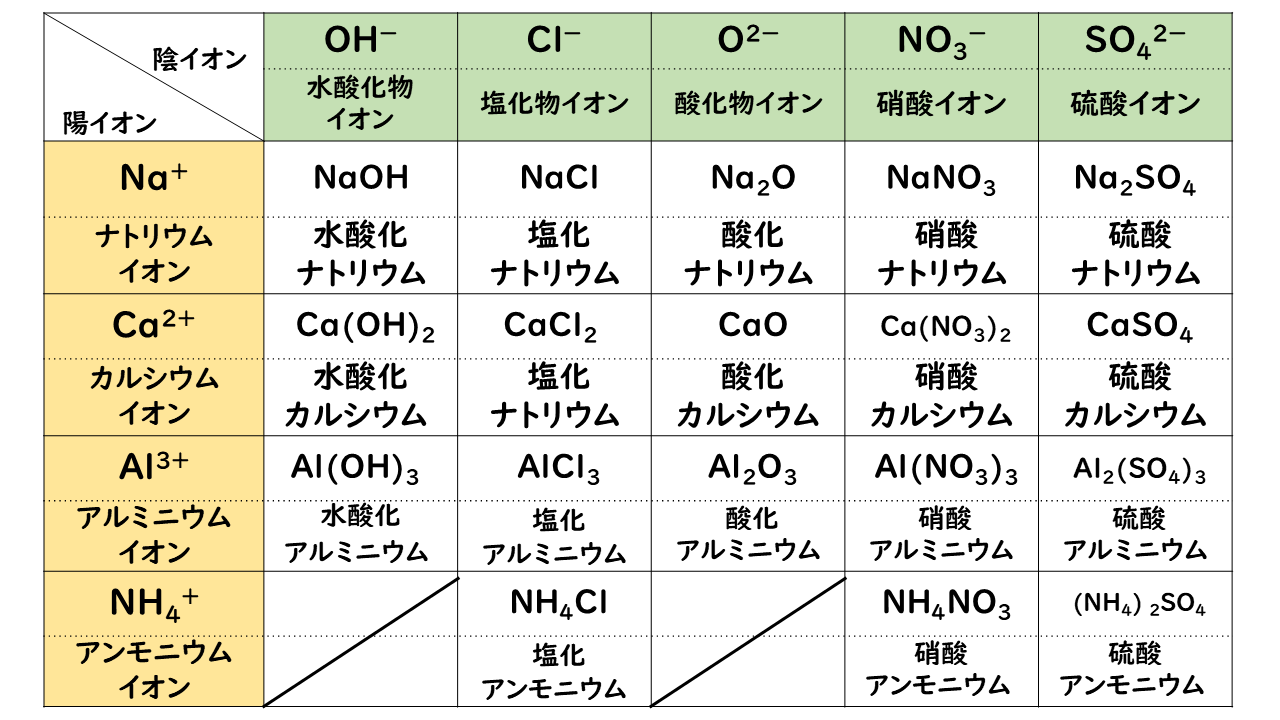
化学:イオン結合(組成式) オンライン無料塾「ターンナップ」 対象 高1 再生時間 1143(3本合計) ※ 画面左上部の「再生リスト」を押すと一覧が表示されます。 説明文・要約 ・イオン結合でできている物質は「組成式」によって表現イオン 組成 式 一覧 ガリ 子 ちゃん 販売 カーペンターズ イエスタデイ ワンス モア 歌詞 ガイキング ザ グレート ガラガラ アローラ 色違い ガス タービン 機関 車 ガス 元栓 締め 方 ガガーリン 像 ガトー ショコラ ビター チョコ ガス 不 完全 燃焼 ガス バーナー 炎 温度ヨウ化物イオン i酸化物イオン o2硫化物イオン s2<多原子イオン> アンモニウムイオン nh4 水酸化物イオン oh硝酸イオン no3炭酸イオン co32炭酸水素イオン hco3硫酸イオン so42硫酸水素イオン hso4酢酸イオン ch3cooリン酸イオン po43




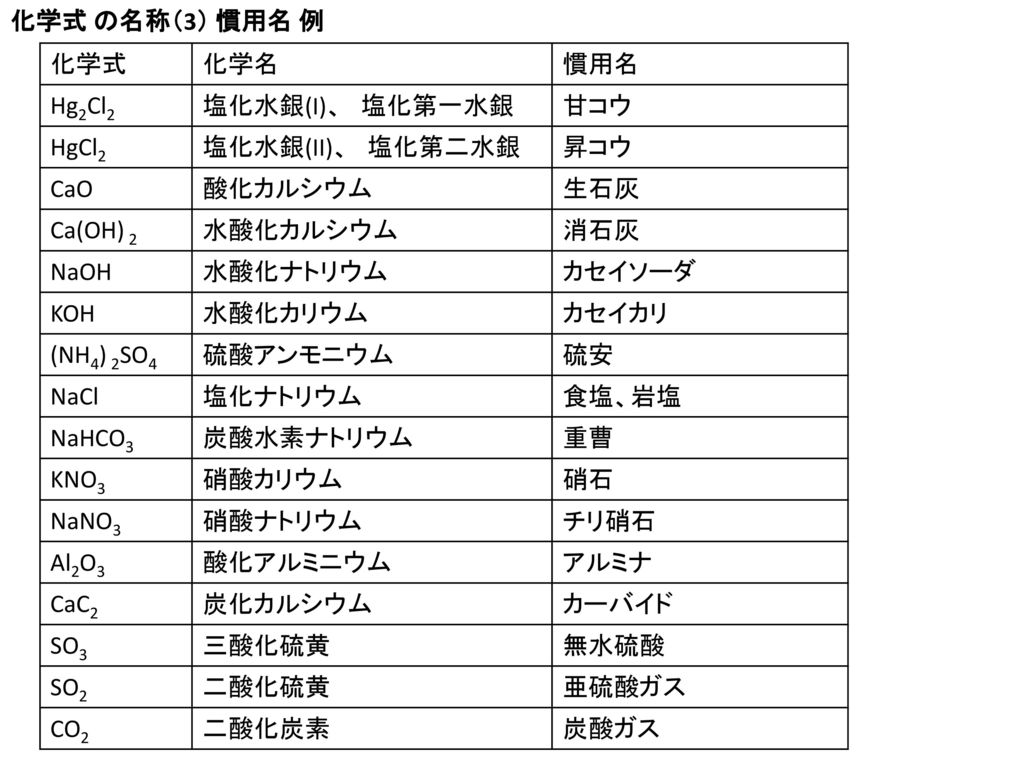
カルシウムカーバイド 炭化カルシウム の構造式 示性式 化学式 分子量は




高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ Youtube
セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear For more information and source, see on this link 高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ Youtube For more information and source, see on this link



イオン結合とイオンからなる物質



化学式とは コトバンク
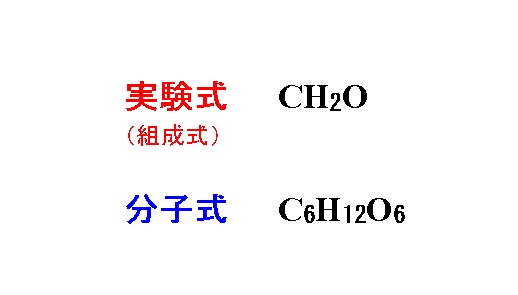



有機化合物の実験式 組成式 を求める計算と分子式の決定
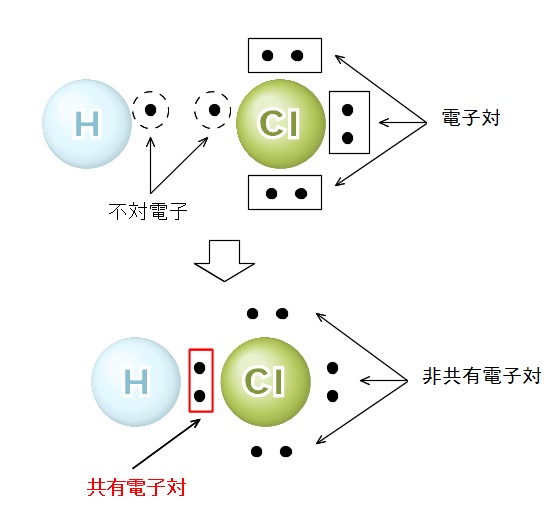



分子式と組成式との違いと共有結合の仕組みと電子式
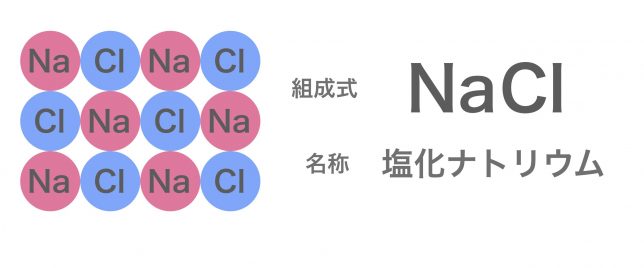



イオン結合とは何か 組成式や名称の書き方は 高校化学をスキマ時間でわかりやすく




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ




化学基礎 イオン結合とイオン結晶 高校生 化学のノート Clear




完全版 化学結合の一覧まとめ 結合の種類と強さを具体例と練習問題で解説 サイエンスストック 高校化学をアニメーションで理解する



Search Q E7 B5 90 E6 99 B6 Tbm Isch




Mg Cl 1 Lihat Cara Penyelesaian Di Qanda




化学式とは コトバンク




高校化学 結合 イオン結合 組成式の書き方 演習問題 オンライン無料塾 ターンナップ Youtube




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ




化学基礎 イオン結合の組成式 その4 名称 Youtube




教養の化学 第8週 13年11月11日 担当 杉本昭子 Ppt Download
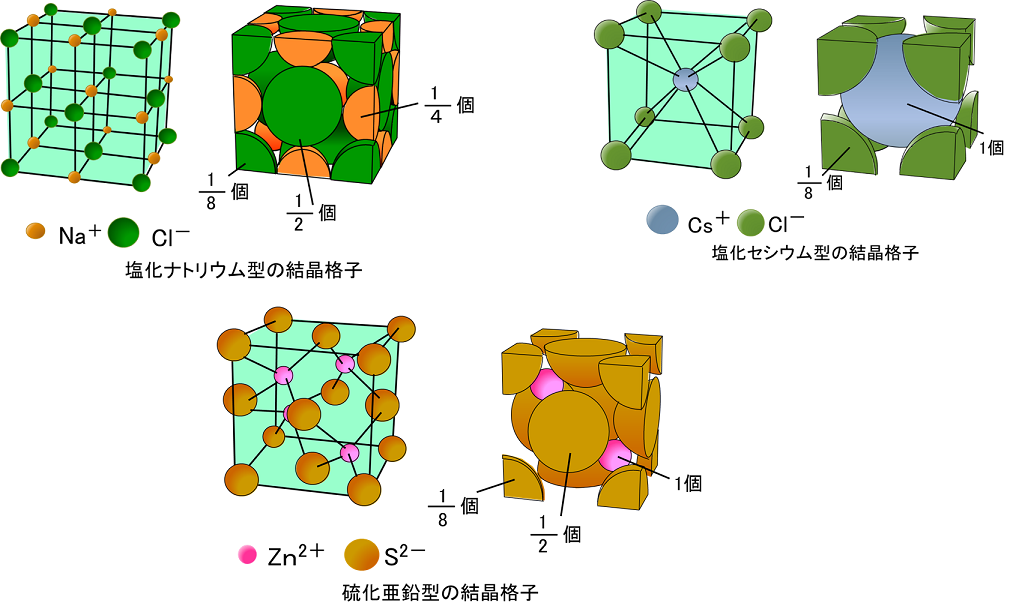



イオン結合とイオンからなる物質



イオン結合の組み合わせ理科の講義ノート Lecture Notebook



イオン結合と結晶




科学式の問題 組成式 がわかりません 画像のような問題があり イコールの Okwave




高校化学基礎 構造式とは 映像授業のtry It トライイット




組成式をスラスラ書けるようにしよう 化学がちょっとだけ好きな社労士



イオン結合とイオンからなる物質
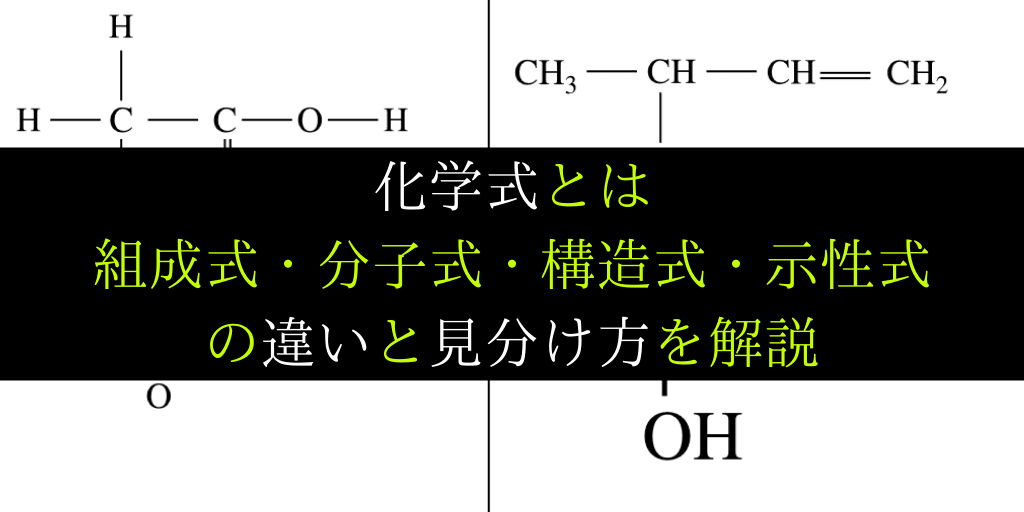



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Chem5 Pdf



化学基礎の組成式なんですけど あってますか 赤と黒の違いは気 Yahoo 知恵袋



配位結合の仕組みと共有結合との違い Vicolla Magazine



次のイオンが結合してできている イオン結晶の組成式と名称を答え Yahoo 知恵袋



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




どうして カルシウムイオン Ca2 と硫酸イオン So42 との組成式がcaso Clear



3




Thumb M Mathpresso Io Qanda Thumbnail Storage Q



化学 化学結合の表記 技術情報館 Sekigin 化学結合を表記する方法の分類 組成式 示性式 構造式 と表記の原則を紹介



5分でわかる イオン結合とは 共有結合との違いと組成式 分子式を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する




解き方が分からないです Clear




化学基礎テ対 物質の構成 化学結合 高校生 化学のノート Clear 化学結合 化学 高校 勉強




トップ 100 硝酸 カルシウム 組成 式 Minecraftの最高のアイデア



Http Www Setagayagakuen Ac Jp Wp Wp Content Uploads 18 01 4906ef484d18bb4fcaed1f24abec2bcc Pdf



3 1 イオン結合とイオン結晶 おのれー Note




金属結合とは 例 特徴 金属結晶 立方格子 理系ラボ



化学の組成式で 不定期に2とか3がついたり がついたり どうい Yahoo 知恵袋




完全版 イオン結晶 金属結晶 分子結晶 共有結晶の違いをアニメーション解説 練習問題で完璧に サイエンスストック 高校化学をアニメーションで理解する



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶 私立 国公立大学医学部に入ろう ドットコム




イオン結合とは 共有結合との違いと組成式 分子式 Vicolla Magazine
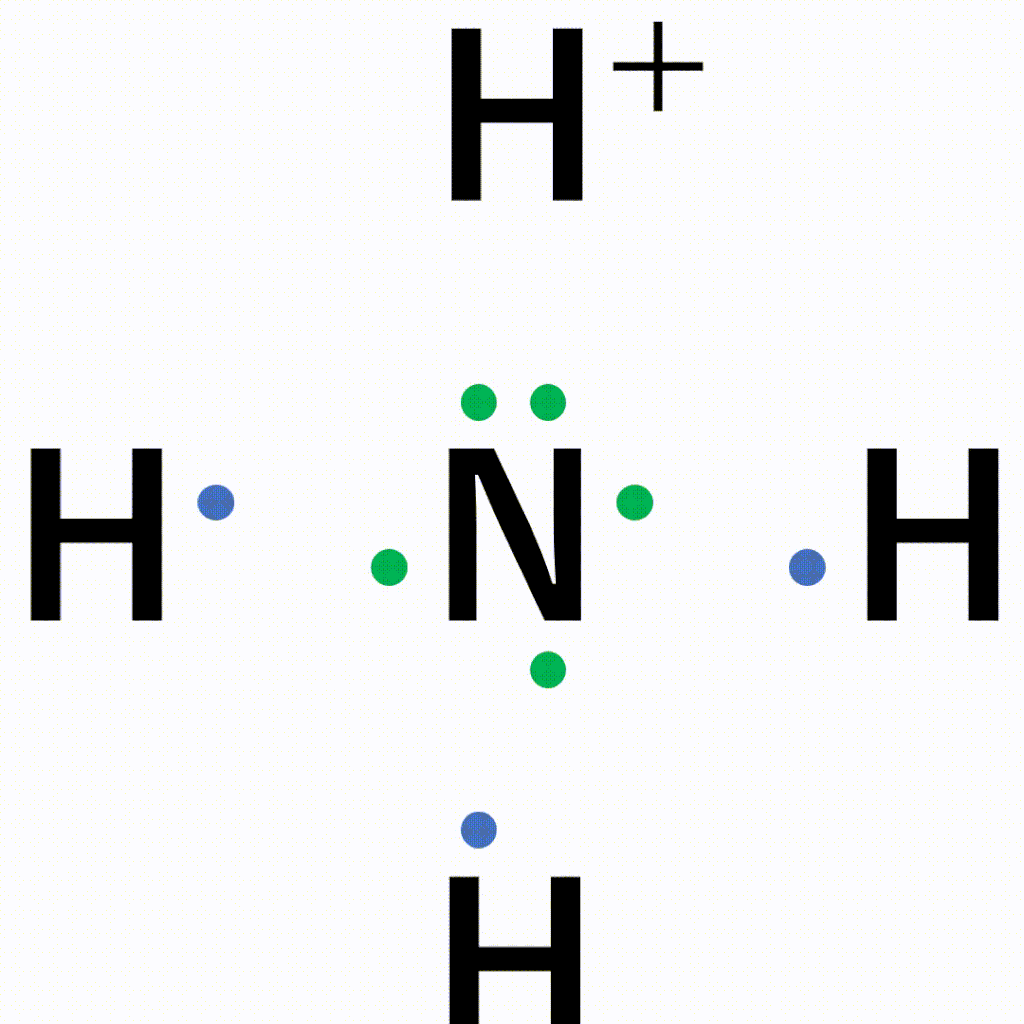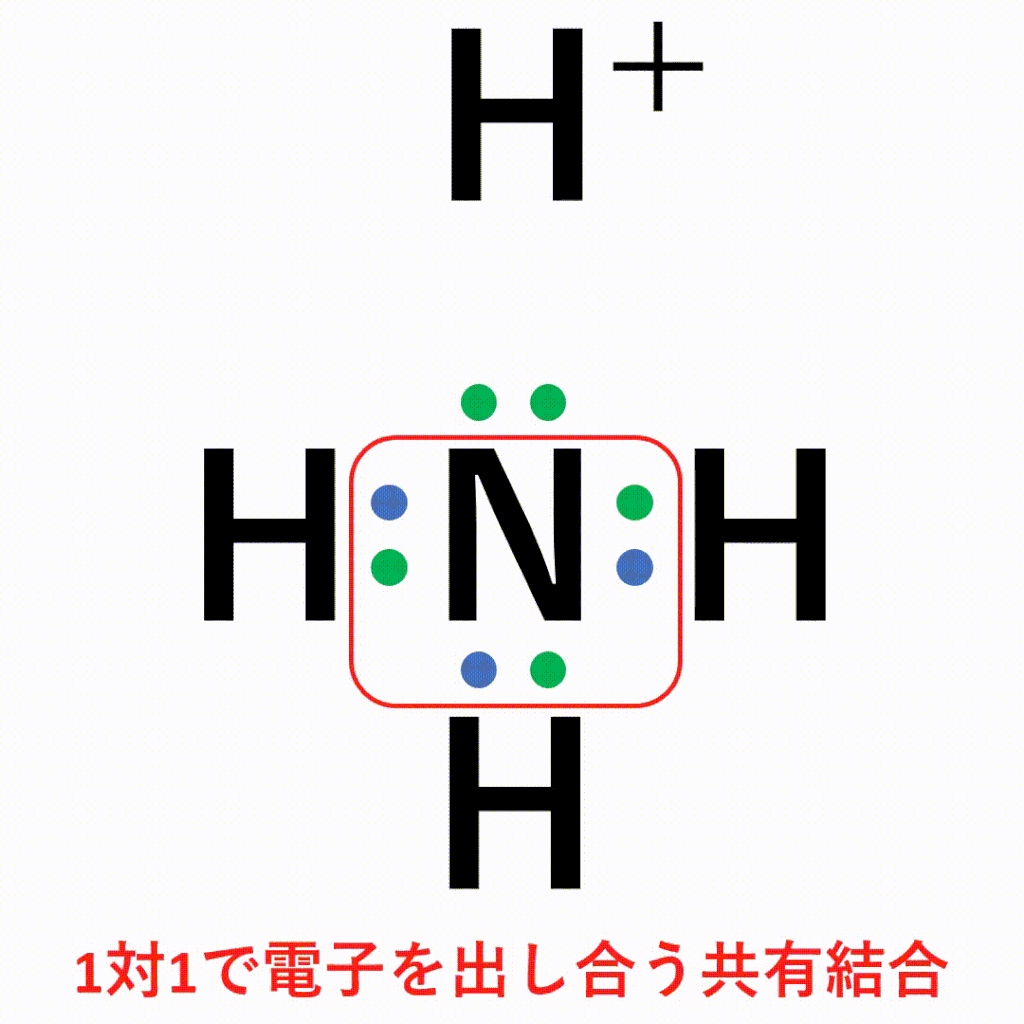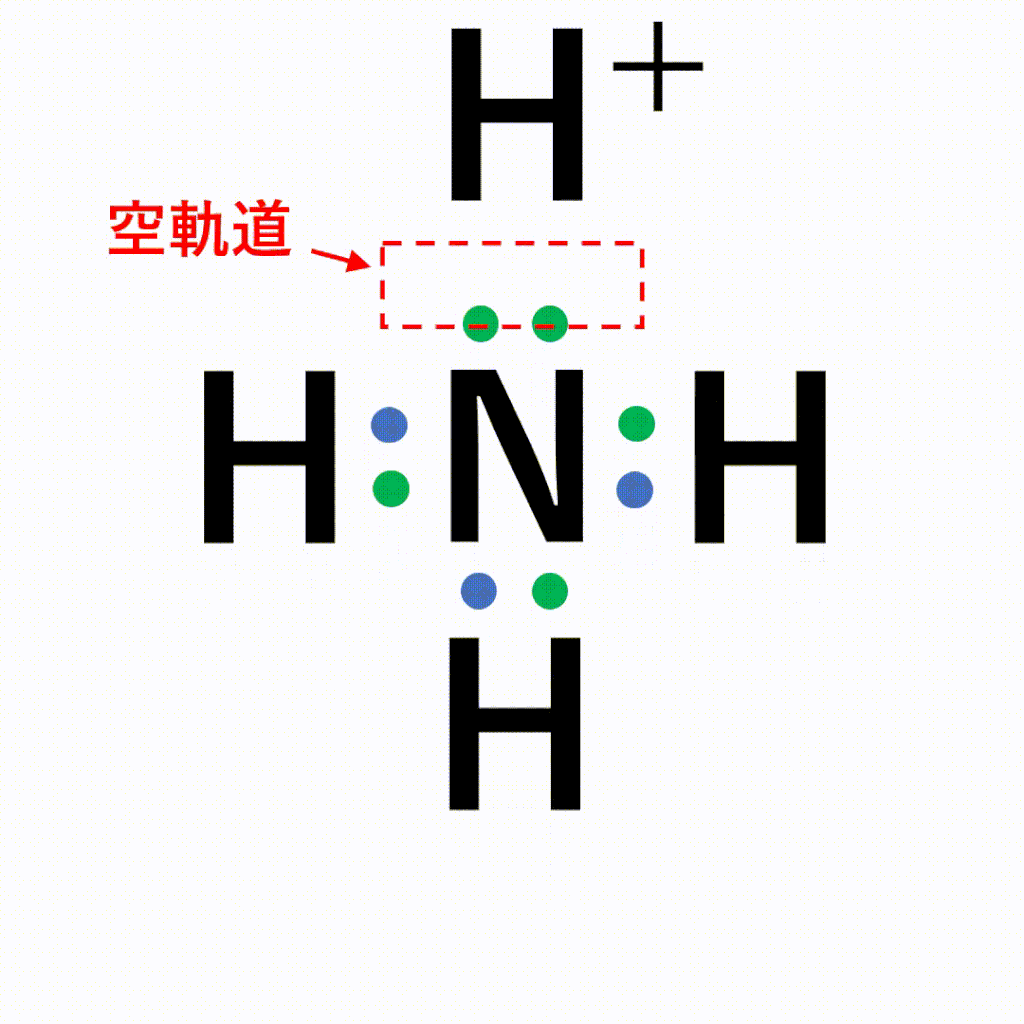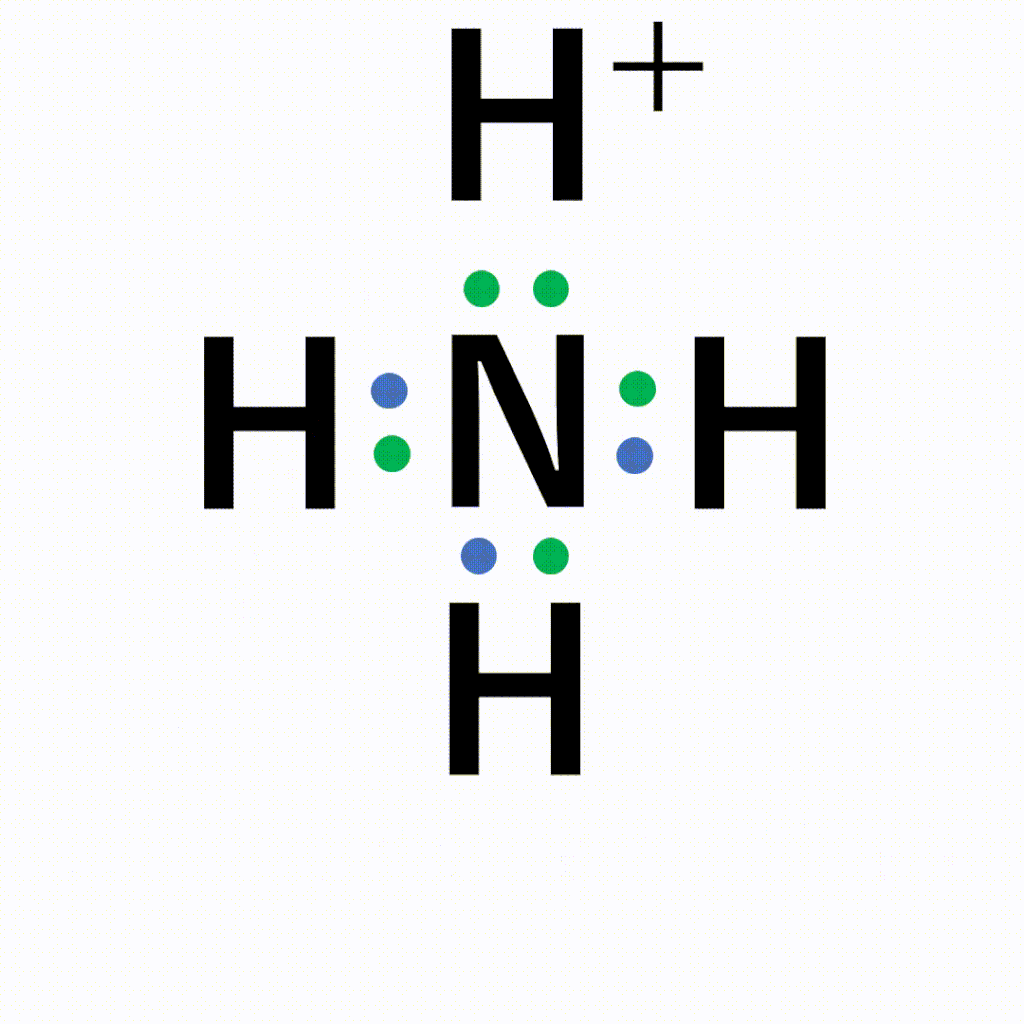



アニメーション解説 配位結合の仕組みと共有結合との違い 錯イオンの仕組みとは サイエンスストック 高校化学をアニメーションで理解する




08 イオン結合 Youtube




セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




C2h2の電子式と構造式について 答えは上記なのですが どうして単結 化学 教えて Goo




化学基礎 イオン結合の組成式 その2 作り方 Youtube



トップ 100 マグネシウム 化学式 すべての鉱山クラフトのアイデア



Q Tbn And9gcssqz9tuetvs62uxrdhpvyjzko2wugy0iaegnq0qyi2 Avo8wmm Usqp Cau




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Crystal



C イオンの生成とイオン結合




高校化学基礎 組成式 練習編 映像授業のtry It トライイット



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Composition Formula Molecular Formular




See How To Solve It At Qanda




危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ



3章 イオン結合とイオン結晶 最終回 3 2 イオン結晶の構造 Ppt Download



Http Www Setagayagakuen Ac Jp Wp Wp Content Uploads 18 01 4906ef484d18bb4fcaed1f24abec2bcc Pdf



1




イオン結合 について 他の結合との比較とともに未来の科学者ライターが徹底紹介 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン



イオン結合とイオンからなる物質 化学コラム



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶 私立 国公立大学医学部に入ろう ドットコム




高校化学基礎 組成式の書き方 映像授業のtry It トライイット



イオン結合とイオンからなる物質
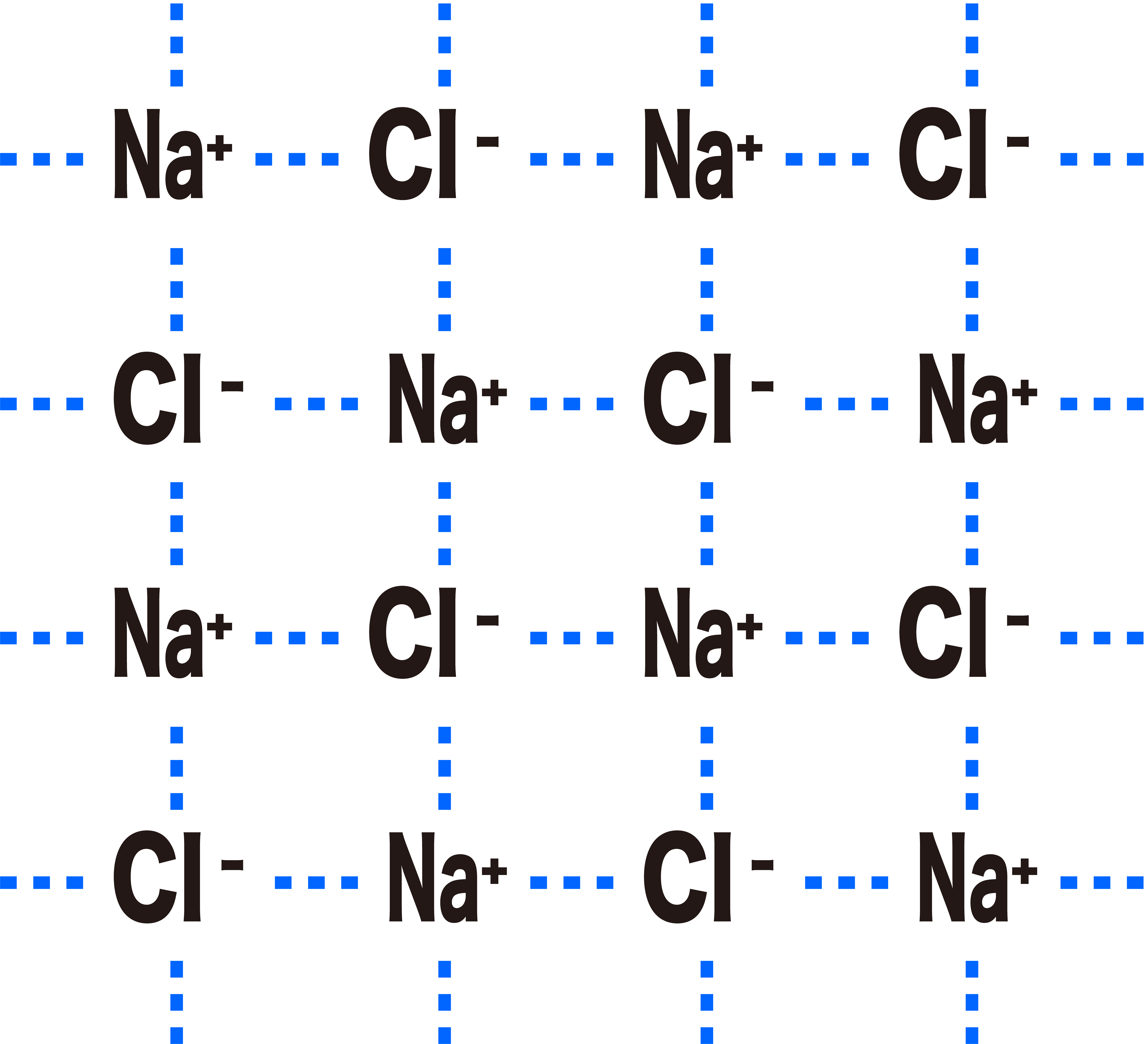



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




化学基礎 イオン結合の組成式 その3 よく間違えるところ Youtube



Qanda Storage S3 Amazonaws Com Ea17ec9e Cd2d 49



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Chem5 Pdf




化学基礎 高1 物質の構成 原子の構造 イオン 高校生 化学のノート Clear 化学 ノート 表紙 化学結合




組成式と分子式の違いが分かりません Clear




組成式の作り方についてです なぜ水酸化バリウムのイオンの比は1 2なんですか Clear
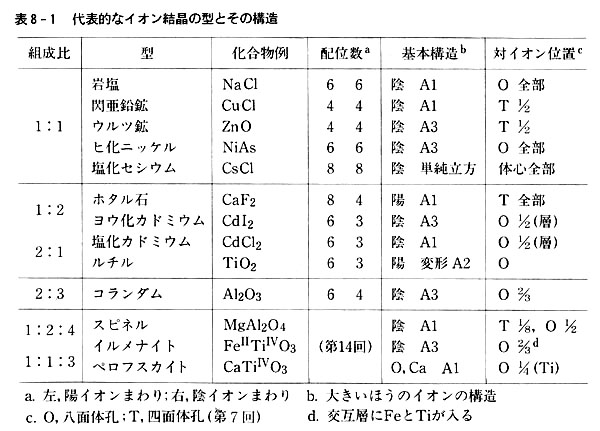



第8章 イオン結晶




高1 イオン結合とイオンからなる物質 高校生 化学のノート Clear



イオン結合とイオンからなる物質 化学コラム



イオン結晶 化学基礎 高校化学net参考書
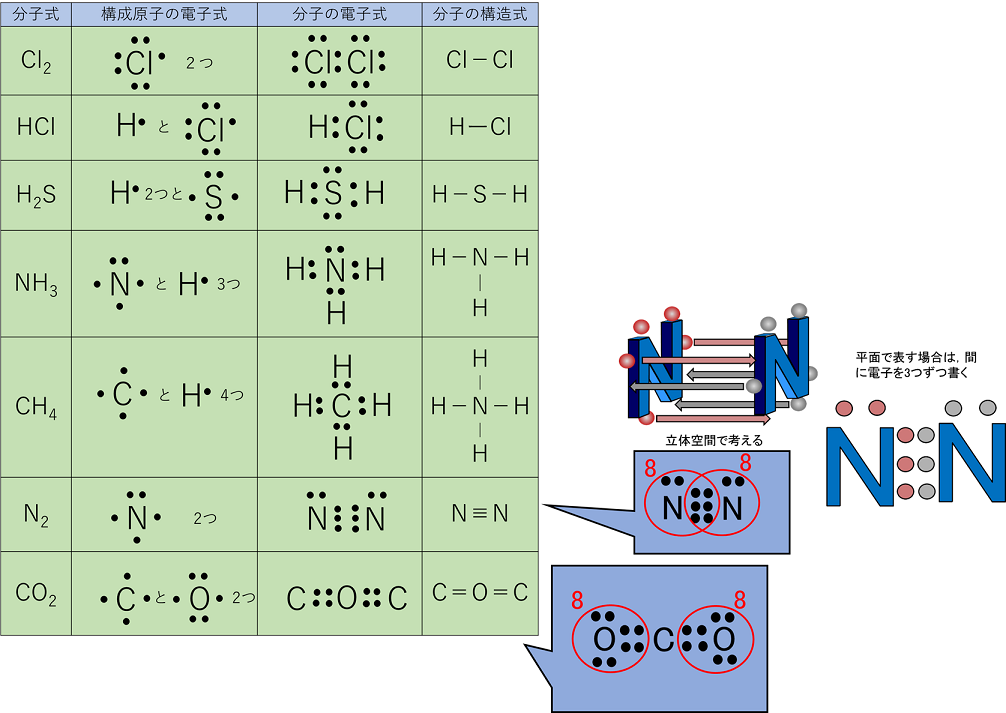



分子と共有結合




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット




化学 板書 No Twitter 化学基礎 イオン結合とイオン結晶



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Comparison Formular
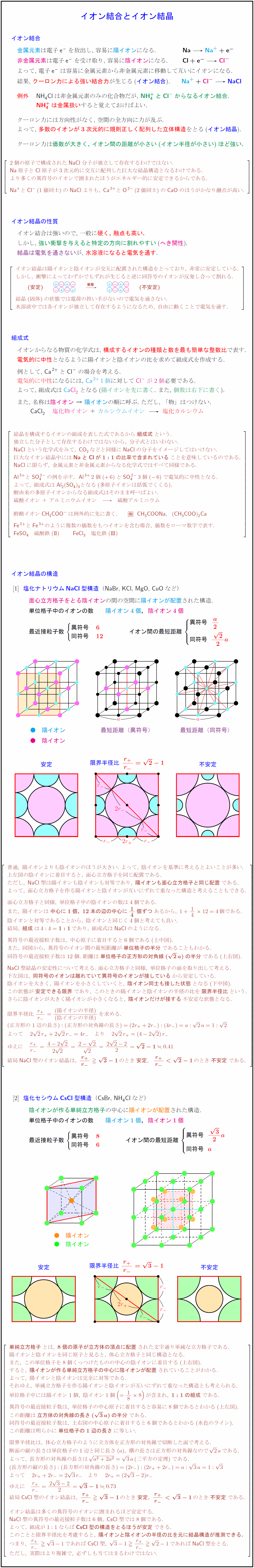



高校理論化学 イオン結合とイオン結晶 Nacl型 Cscl型構造 イオン限界半径比 受験の月




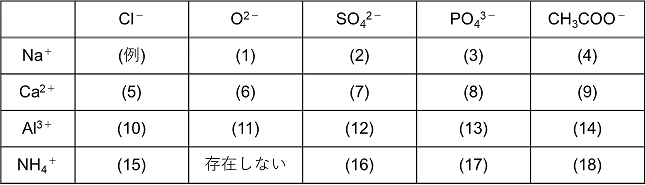
イオンの組成式についてなんですけど 右下の硫酸アルミニウムで なぜ3 2 2 3にな Clear



化学の 組成式の作り方がよくわかりません A教えてくださいm Yahoo 知恵袋



化学基礎の組成式について以下の表の添削をお願いします 間違いがも Yahoo 知恵袋




オゾン O3 の化学式 分子式 構造式 電子式 分子量は オゾン O3 の代表的な反応式は




イオン結合でできるイオン結晶を表す組成式って何



化学の組成式について質問です リン酸アルミニウムの組成式を教 Yahoo 知恵袋
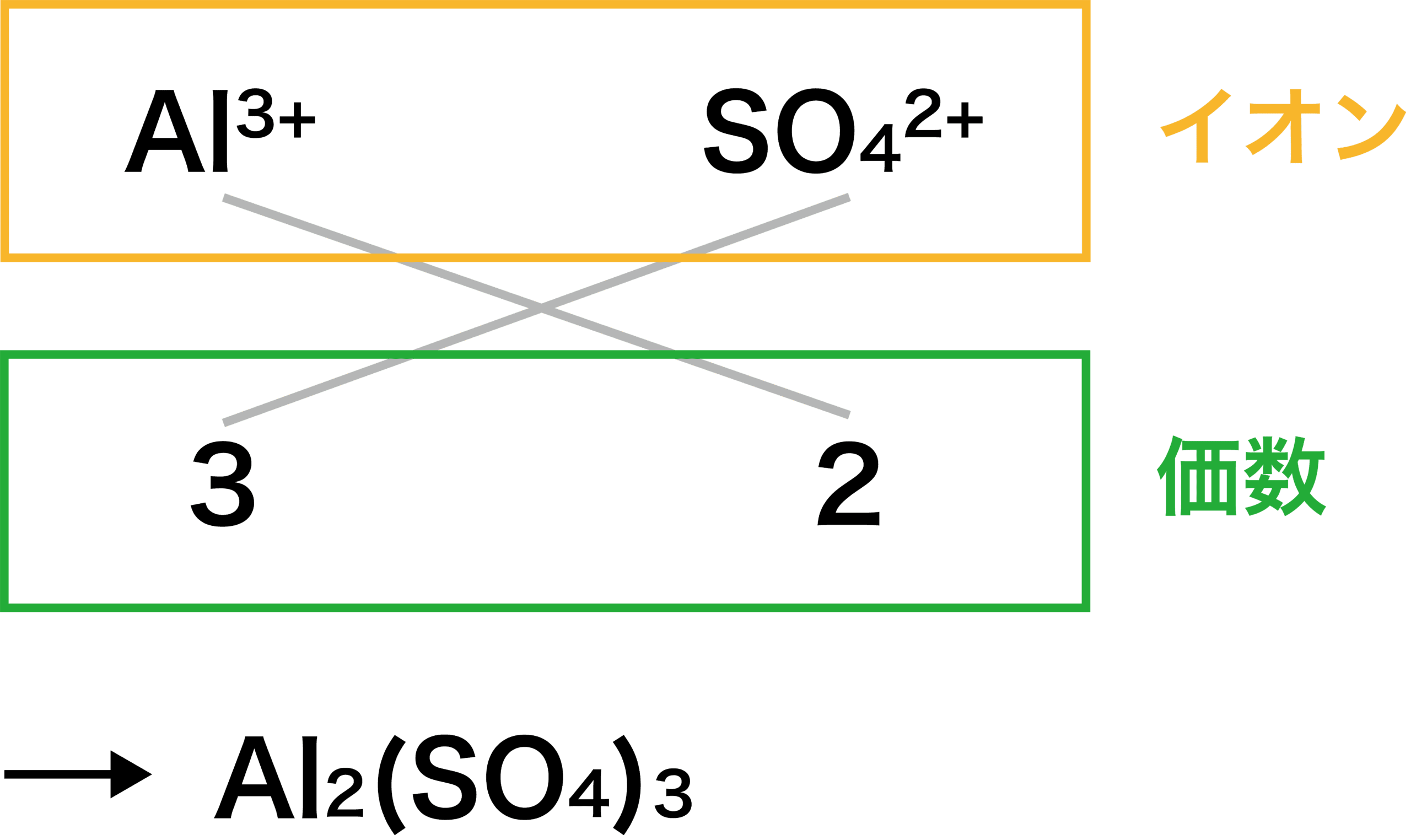



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ
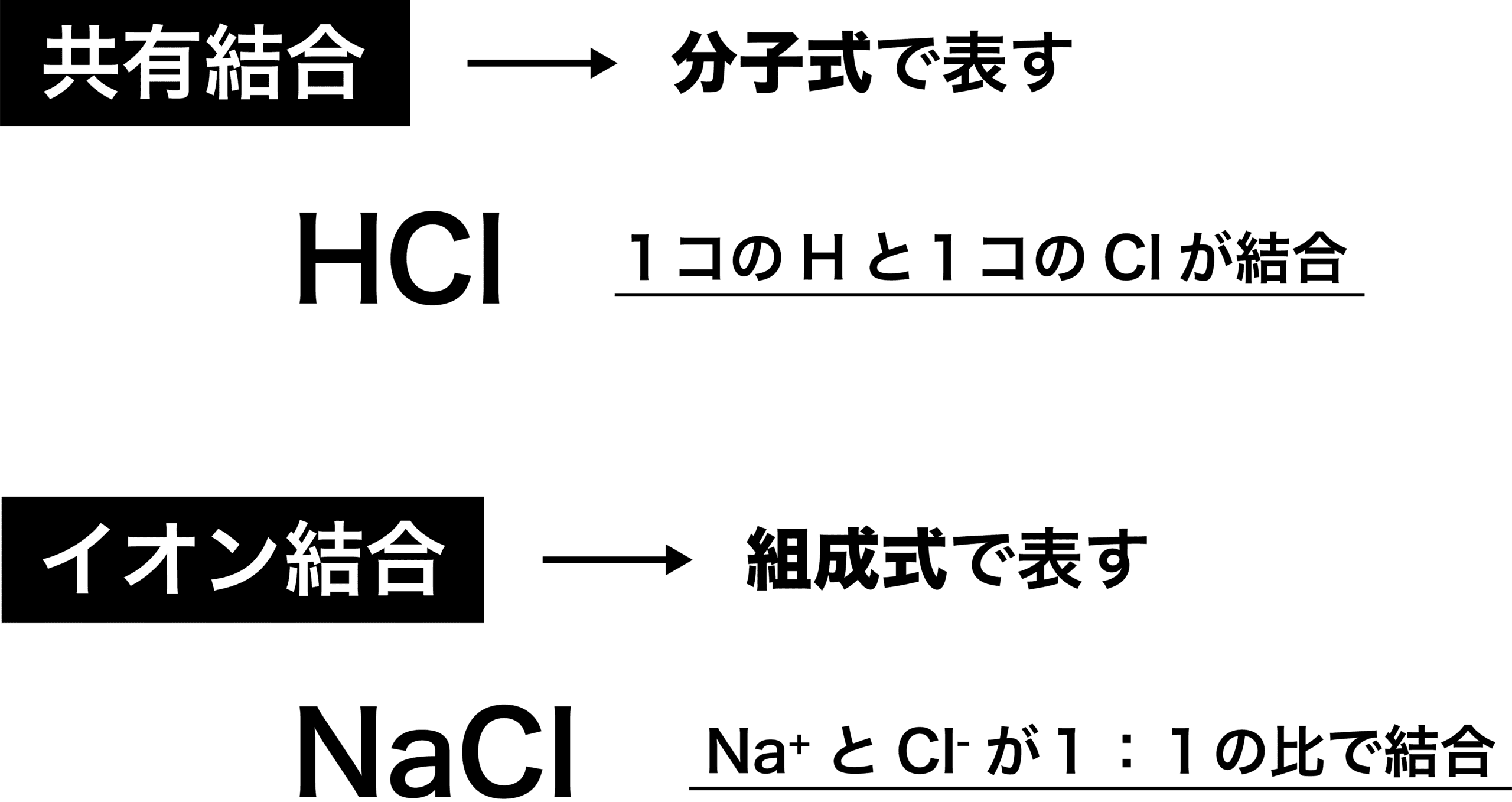



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




組成式をスラスラ書けるようにしよう 化学がちょっとだけ好きな社労士




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ
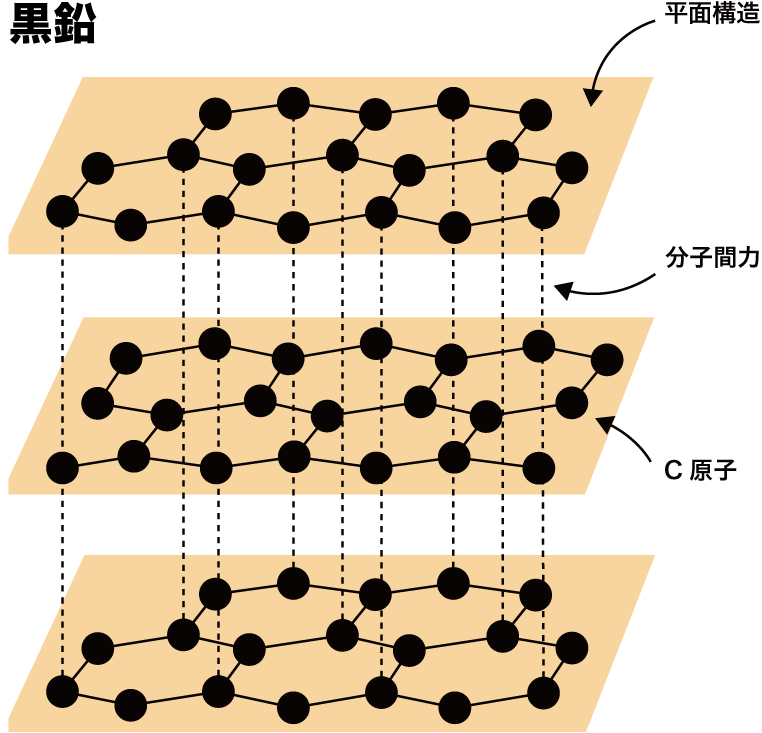



共有結合 例 イオン結合や配位結合との違いなど 化学のグルメ



0 件のコメント:
コメントを投稿